Der Morbus hämolyticus neonatorum (Mhn) ist durch eine hämolytische Anämie des Feten bzw. des Neugeborenen in unterschiedlicher Ausprägung gekennzeichnet.
Pathogenese
Ursache dieses Geschehens ist ein mütterlicher Antikörper gegen Blutgruppen-Eigenschaften auf den kindlichen Erythrozyten. Der Antikörper wird durch die Placenta transportiert, bindet an das korrespondierende Antigen auf den kindlichen Erythrozyten (wenn vorhanden) und führt zu einer kindlichen Hämolyse.
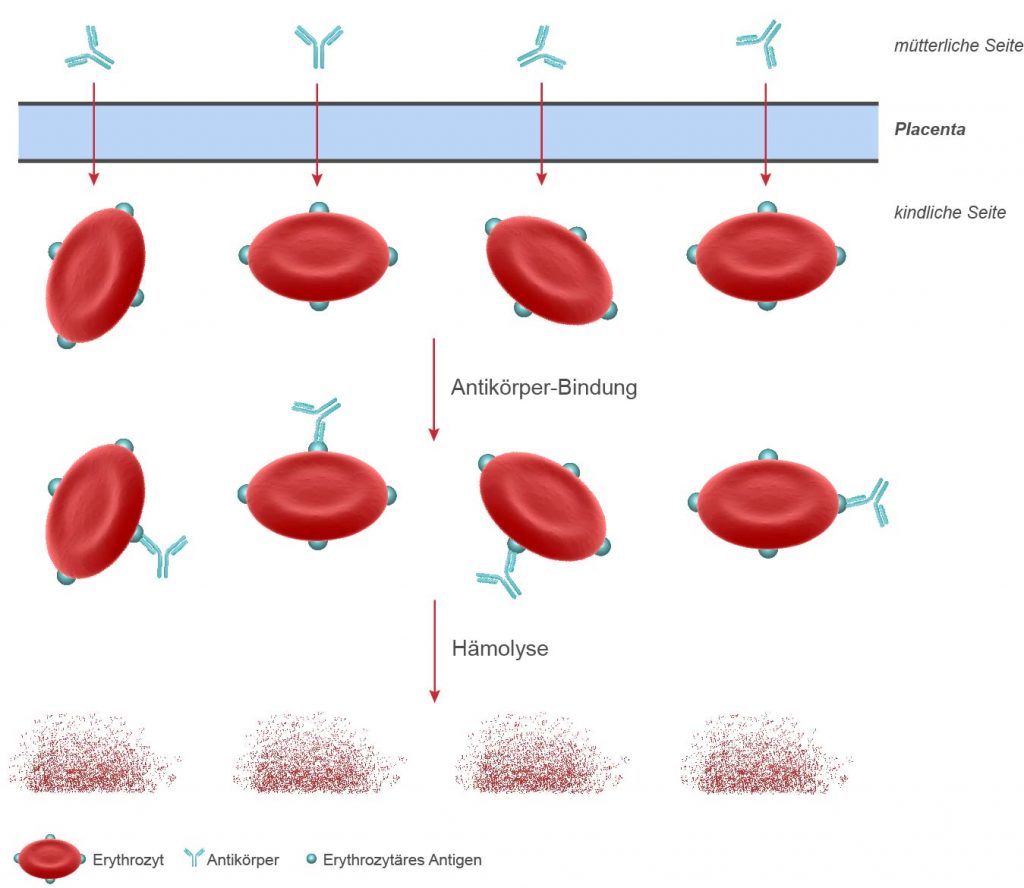
Damit sich ein Mhn entwickeln kann, müssen folgende pathogenetischen Bedingungen erfüllt sein:
- Der Fetus muss ein Blutgruppenantigen (z.B. das D-Antigen) besitzen, das seiner Mutter fehlt.
- Die Mutter muss durch vorangegangenen Kontakt zu diesem Antigen einen entsprechenden Antikörper gebildet haben.
- Der gebildete Antikörper muss Plazenta-gängig sein, d.h. er muss die Plazenta passieren können, um in den kindlichen Kreislauf zu gelangen.
ad 1) Blutgruppenantigen
Meist handelt es sich um ein Antigen im Rhesus-System, das der Fetus vom Vater geerbt hat und welches der Mutter fehlt. Klassisch ist die Konstellation:
- Vater Rh-positiv
- Mutter Rh-negativ
- Kind Rh-positiv
Grundsätzlich ist die Auslösung eines Mhn aber nicht auf Antikörper gegen das D-Antigen beschränkt, sondern auch bei vielen anderen Blutgruppenantigenen möglich. Im Rh-System wird neben dem D-System eine entsprechende Konstellation immer wieder im C-System (z.B. Vater CC, Mutter cc, Kind Cc), aber auch (jedoch seltener) im E-System beobachtet.
ad 2) Mütterlicher Kontakt zu erythrozytärem Antigen
Grundsätzlich ist ein solcher Kontakt auf verschiedene Weise möglich.
- Am häufigsten ist der Kontakt von kindlichem Blut mit dem mütterlichen Kreislauf. Dies passiert meist während des Geburtsvorganges. In der Folge kann die Mutter einen Antikörper entwickeln, der dann bei einer weiteren Schwangerschaft mit gleicher kindlicher Blutgruppe einen Mhn auslösen kann (Mhn treten meist nicht während der ersten, sondern ab der zweiten Schwangerschaft auf). Aber auch andere Ereignisse wie Amniozentesen, Schwangerschaftsabbrüche oder Wendemanöver können zu Kontakt von kindlichem Blut mit dem mütterlichen Kreislauf führen.
- Eine andere Alternative ist die Bluttransfusion, durch die eine entsprechende Antikörperbildung ausgelöst werden kann. Erhält beispielsweise eine Rh-negative Patientin ein Rh-positives Erythrozytenkonzentrat, so bildet sie mit hoher Wahrscheinlichkeit (ca. 50 -70%) einen anti-D-Antikörper (s. Rh-D-inkompatible Transfusion). Dieser kann dann bei einer Schwangerschaft mit einem Rh-positiven Kind zu einem späteren Zeitpunkt einen Mhn auslösen.
ad 3) Plazentagängigkeit von Antikörpern
Nicht alle im mütterlichen Kreislauf vorhandenen Antikörper können die Plazentaschranke überwinden und in den fatalen Kreislauf gelangen. Nur die relativ kleinen Antikörper vom Typ IgG können (mittels Pinocytose) über die Plazentaschranke transportiert werden. Größere Antikörper vom Typ IgM gelangen in der Regel nicht über die Plazentaschranke.
Symptomatik
In utero resultiert diese hämolytische Anämie bei entsprechender Ausprägung in der Regel in einem sog. Hydrops fetalis. Hierbei handelt es sich um eine Ergußbildung in zwei oder mehr Körperhöhlen (z.B. Ascites, Pleuraerguß) und/oder generalisierten Anasarka. Als Ursache der Ergüsse wird eine durch die kompensierende extramedulläre Hämatoposese reduzierte Syntheseleistung der fetalen Leber und eine daraus resultierende Hypoalbuminämie sowie eine erhöhte kapillare Permeabilität aufgrund des durch die Anämie generierten Sauerstoffmangels diskutiert.
Postpartal steht meist die Hyperbilirubinämie im Vordergrund. Während intrauterin das durch die Hämolyse anfallende Bilirubin über die Placenta in den mütterlichen Kreislauf transportiert und dort durch die mütterliche Leber weitgehend abgebaut werden kann, fehlt diese Kompensationsmöglichkeit nach der Entbindung. Damit ist die durch die physiologische Unreife und durch die extramedulläre Hämatopoese ohnehin geschädigte kindliche Leber überfordert, so dass das anfallende Bilirubin nicht mehr in ausreichendem Maße eliminiert wird und akkumuliert. Wird eine bestimmte Konzentration überstiegen (die individuell sehr unterschiedlich sein kann und bei Frühgeborenen unter Umständen schon bei 10 mg/dl beginnt), so lagert sich das Bilirubin an bestimmten zentralen Strukturen wie Basalganglien und Hinnervenkernen an und färbt diese gelb („Kernicterius“). Die Folge ist eine Enzephalopahtie mit neurologischen Störungen wie Apathie, Trinkschwäche und/oder Krampfanfälle.
Diagnostik
Neben der gynäkologischen Diagnostik (z.B. Ultraschall zum Nachweis eines Hydrops fetalis, Dopplersonographie der A. cerebri media zum Nachweis einer fetalen Anämie, ggf. Nabelschnurpunktion mit Bestimmung des fetalen Blutbildes) spielen vor allem immunhämatologische Untersuchungen eine wichtige Rolle. So wird bei jeder schwangeren Frau unmittelbar nach Feststellung der Schwangerschaft sowie in der 24ten bis 27ten Schwangerschaftswoche ein Antikörpersuchtest durchgeführt, um irreguläre mütterliche Antikörper zu erkennen. Findet sich ein solcher Antikörper, muss untersucht werden, gegen welches Antigen er gerichtet ist. In einem nächsten Schritt ist es empfehlenswert, väterliches Blut hinsichtlich dieses Antigens zu untersuchen. Weist der Vater das Antigen nicht auf, so ist ein Mhn ausgeschlossen, da auch der Fetus das entsprechende Antigen dann nicht besitzen wird. Weist der Vater dagegen das Antigen auf und handelt es sich um einen „plazentagängigen“ Antikörper, so muss mit einem Mhn gerechnet werden.
Im Übrigen ist man in Speziallaboratorien heute in der Lage, aus Fruchtwasser und zum Teil selbst aus dem Blut der Mutter gentechnologisch die Blutgruppe des Kindes zu bestimmen und damit auch ohne väterliches Blut nachzuweisen, ob ein Risiko für einen Mhn besteht.
Therapie
In utero ist eine Therapie schwierig. Hier bleibt nur die Nabelschnurpunktion mit nachfolgender intrauteriner (Austausch-)Transfusion mit Blut, welches das zum Antikörper korresponierende Antigen nicht besitzt. Da diese Therapieform nicht ohne Risiko ist, sollte sie nur in dafür spezialisierten Zentren und auch nur dann durchgeführt werden, wenn ohne Eingreifen mit dem intrauterinen Absterben oder schweren Dauerschäden zu rechnen ist.
Post partum richtet sich die Therapie nach der Schwere des Krankheitsbildes.
a) Phototherapie
Bei dieser von R. J. Cremer et al. im Jahre 1958 publizierten Therapie werden die Neugeborenen mit elektromagnetischen Wellen im sichtbaren Bereich (400 – 500 nm) bestrahlt. Dies führt zu einer Oxidation und Spaltung des indirekten Bilirubins in der Haut; die Abbauprodukte können renal eliminiert werden. Allerdings eignet sich diese Therapieform nur bei sehr milden Formen des Mhn.
b) Neugeborenen-Transfusion
Die nächste Stufe in der Therapie-Eskalation stellt die Neugeborenen-Transfusion dar. Präparat der Wahl ist ein Erythrozytenkonzentrat, welches das zum auslösenden Antikörper korrespondierende Antigen nicht besitzt.
c) Austauschtransfusion
In der 3ten Stufe folgt die Austauschtransfusion des Neugeborenen. Als Indikation hierfür gilt bei reifen Neugeborenen in der Regel ein Bilirubinwert über 30 mg/dl (Details s. entsprechende MWMF-Leitlinie). Präparat der Wahl ist ein in GFP suspendiertes Erythrozytenkonzentrat, welches das betroffene Antigen nicht aufweist. Die übliche Austauschtransfusion mit dem zweifachen Blutvolumen des Neugeborenen entfernt etwa 80% der von der Antigen-Antikörperreaktion betroffenen kindlichen Erythrozyten. In schweren Fällen können mehrere Austauschtransfusionen erforderlich sein. Die Erythrozytenkonzentrate müssen zur Prophylaxe einer Graft-versus-Host-reaktion (GvH) radioaktiv bestrahlt werden.
Neben diesen klassischen Therapieoptionen wird auch immer wieder die Gabe von Immunglobulinen diskutiert. Hintergrund ist die Vorstellung, den Abbau der Antiköper-beladenen Erythrozyten durch Blockade der Fc-Rezeptoren in Leber und Milz zu verlangsamen. Da jedoch mehrere Fälle einer nekrotisierenden Enterocolitis als Nebenwirkung der Immunglobulingabe beschrieben wurden, kann diese Therapieoption entsprechend der aktuellen Leitlinien der Gesellschaft für Neonatologie und Pädiatrischen Intensivmedizin (Stand 08/2015) nicht empfohlen werden.
Prophylaxe
Da ein Mhn auch heute noch in vielen Fällen durch einen anti-D-Antikörper ausgelöst wird, ist die beste Prophylaxe die Verhinderung der anti-D-Bildung bei Frauen im gebährfähigen Alter. Dies geschieht durch Applikation von 300 µg des anti-D-Antikörpers (Anti-D-Immunglobulin) bei Rh-negativen schwangeren Frauen nach der Geburt eines Rh-positiven Kindes (deshalb muss bei Rh-negativen Müttern postpartal immer die Blutgruppen des Neugeborenen bestimmt werden). Das applizierte Anti-D zerstört umgehend die beim Geburtsvorgang in den mütterlichen Kreislauf gelangten Rh-positiven kindlichen Erythrozyten, so dass das mütterliche Immunsystem keine Gelegenheit hat, selbst einen anti-D-Antikörper zu bilden. Gleiches gilt bei allen Aborten, nach jeder Amniozentese, nach Schwangerschaftsabbruch, nach Wendungsoperationen bei Rh-negativen Frauen (also immer dann, wenn die Gefahr besteht, dass kindliche Erythrozyten in den mütterlichen Kreislauf gelangen). Die Applikation sollte spätestens 72 Stunden nach dem Ereignis erfolgen.
Bereits vor vielen Jahren ist man dazu übergegangen, bei Rh-negativen Frauen auch während der Schwangerschaft einmal 300 µg anti-D zu injizieren (27. – 29. Schwangerschaftswoche). Hierdurch kann das Risiko einer Immunisierung noch weiter reduziert werden. Ursprüngliche Bedenken, dass das applizierte Anti-D diaplanzentar transportiert wird und bei Rh-positiven Feten einen Mhn auslösen könnte, haben sich nicht bewahrheitet – hierzu ist die applizierte Dosis zu gering.
Seit einiger Zeit steht ein PCR-Pränataltest zur Verfügung, mit dem man bei Rh-negativen Frauen aus mütterlichem Blut den Rh-Status des Feten bestimmen kann. Dieser Test kann ab der 11. Schwangerschaftswoche (optimal ab der 18. Schwangerschaftswoche) durchgeführt werden und sollte jeder Rh-negativen schwangeren Frau angeboten werden. Er ist allerdings nicht für Mehrlings-Schwangerschaften geeignet. Sollte der Test ein negatives Ergebnis erbringen (d.h. der Fetus Rh-negativ sein), kann auf eine Anti-D-Prophylaxe während der Schwangerschaft verzichtet werden. Unmittelbar nach der Geburt sollte aber immer – unabhängig vom Ergebnis des Pränataltestes aus mütterlichem Blut – die Blutgruppe des Neugeborenen bestimmt werden (s. oben).
