Das Kell-System wurde im Jahre 1946 durch Sir Robin R. Coombs (1921-2006) entdeckt. Er fand im Serum einer Frau, die ein Kind mit Morbus hämolyticus neonatorum geboren hatte, einen Antikörper, der sowohl mit den Erythrozyten des Neugeborenen als auch mit denen des Ehemanns in dem von ihm entdeckten Coombs-Test reagierte. Der neue Antikörper und das dazugehörige Antigen erhielten den Namen der Patientin: Mrs. Kelleher
3 Jahre später fanden Ph. Levine et. al. wiederum im Serum einer Patientin, welche ein Kind mit leichtem Morbus hämolyticus neonatorum geboren hatte, den für das korrespondierende Allel postulierten Antikörper. Entsprechend dem Namen der Mutter (Mrs. Nocella) hätte man das zugehörige Antigen eigentlich „Nocella“ und den Antikörper anti-Nocella nennen müssen. Es kam jedoch – aus welchen Gründen auch immer – zu einer Umstellung der Buchstaben, so dass aus „Nocella“ „Cellano“ wurde. Entsprechend nannte man den Antikörper anti-Cellano und das Antigen Cellano-Antigen. Später setzte sich für das Kell-Antigen jedoch der Buchstabe K, für das Cellano-Antigen der Buchstabe k durch.
Dem Kell-System liegt ein Genlocus auf dem Chromosom 7 (7q34) zugrunde, das ein Glycoprotein mit 732 Aminosäuren kodiert (Kell-Protein). Das Protein ist mit seinem N-terminalen Ende im Zellinneren fixiert, durchdringt die Zellmembran an einer Stelle und weist extrazellulär 665 Aminosäuren auf. Das Protein ist extrazellulär durch mehrfache Disulfidbrücken stark gefaltet und stellt physiologisch eine zinkabhängige Endopeptidase dar. Es spaltet Endothelin 3, wobei ein potenter Vasoconstrictor entsteht. Allerdings konnte bei Menschen, denen das Kell-Protein fehlt (K0-Typ), keine korrespondierenden Krankheitssymptome (z.B. Hypotonien) nachgewiesen werden.
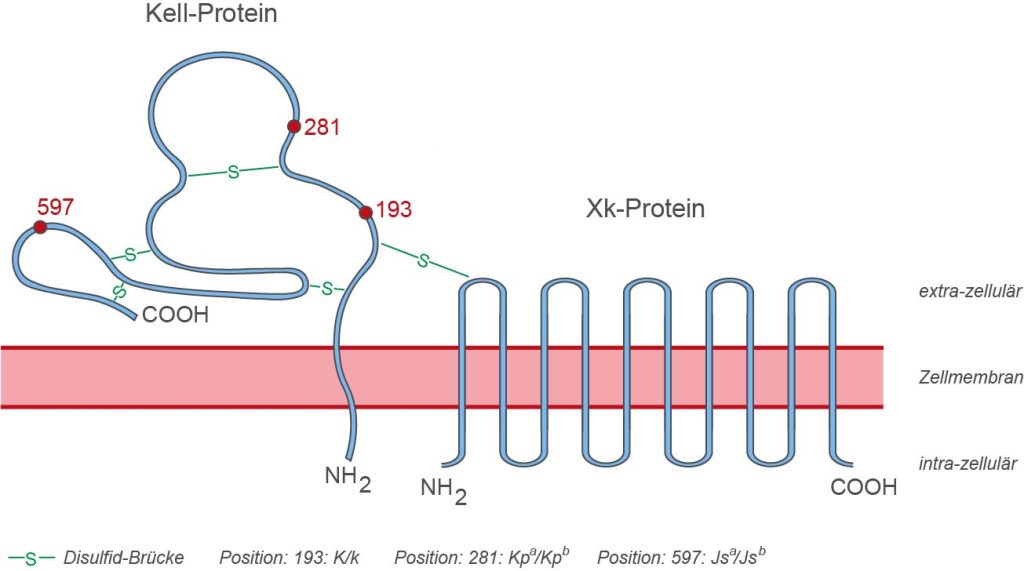
Je nachdem, welche Aminosäuren an den extrazellulären Positionen 193, 281 und 597 des Kell-Proteins kodiert werden, entstehen unterschiedliche Blutgruppen:
| Position | Aminosäure | Antigen | Synonym* |
|---|---|---|---|
| 193 | Methionin | K | Kell (KEL1) |
| Threonin | k | Cellano (KEL2) | |
| 281 | Tryptophan | Kpa | Penny (KEL3) |
| Arginin | Kpb | Rautenberg (KEL4) | |
| 597 | Prolin | Jsa | Sutter (KEL6) |
| Leucin | Jsb | Matthews (KEL7) |
* die offiziellen Synonyme der ISBT (International Society of Blood Transfusion) stellen die Bezeichnungen in Klammern dar. Die Bezeichnungen ohne Klammern sind zwar nicht mehr offiziell, werden aber im täglichen Sprachgebrauch immer noch verwendet und stellen die Namen der Patienten dar, bei denen der Antikörper bzw. das Antigen als erste entdeckt wurden.
Neben den genannten Positionen 193, 281 und 597 gibt es noch an weiteren Positionen des Kell-Proteins unterschiedlich kodierte Aminosäuren, was zu weiteren Blutgruppen im Kell-System führt. Auf diese soll jedoch an dieser Stelle nicht näher eingegangen werden.
Auf der zellulären Oberfläche ist das Kell-Glykoprotein sehr eng an das sog. Xk-Protein assoziiert, das von einem Gen auf dem X-Chromosom kodiert wird (Xp21.1). Es handelt sich um ein aus 444 Aminosäuren bestehendes Protein, das sich 10 mal durch die Zellmembran windet und mit dem Kell-Glykoprotein durch eine Disulfid-Brücke vernetzt ist. Das Xk-Protein stellt einen wesentlichen Faktor für die Stabilisierung der Zellmembran dar. Fehlt es oder wird es verändert exprimiert, entsteht das sog. McLeod-Syndrom.
