Die wichtigste Funktion der HLA-Antigene besteht in der Vermittlung der immunologischen Antwort auf körperfremde Peptide. Sie sind von entscheidender Bedeutung bei der Aktivierung cytotoxischer T-Lymphozyten und T-Helferzellen.
Aktivierung cytotoxischer T-Lymphozyten (Killerzellen)
Bei einem Virusbefall des Organismus dringen die Viren nach Andocken an die entsprechenden Rezeptoren in die jeweiligen Körperzellen ein und bewirken dort die Synthese bestimmter virusspezifischer Proteine. Nachdem diese durch das zytoplasmatische Proteasom intrazellulär gespalten und die entstandenen Peptide in das endoplasmatische Retikulum der befallenen Zellen transportiert wurden, werden sie dort an neu synthetisierte HLA-Moleküle der Klasse I gebunden. Sterisch betrachtet bilden die HLA-Moleküle eine Grube oder Tasche, in welche die Peptide eingelagert werden. Allerdings kann nicht jedes HLA-Molekül alle Peptide binden; die Peptide müssen in die jeweilige Grube bzw. Tasche „passen“. Da unterschiedliche HLA-Antigene unterschiedliche Taschen- oder Grubenform aufweisen, ist es vom HLA-Typ abhängig, welche Peptide gebunden werden können und welche nicht. Mit Hilfe des Golgi-Apparates werden die entstandenen Molekülkomplexe an die Zelloberfläche transportiert. Dort werden sie von CD8-positiven cytotoxischen T-Lymphozyten (Killer-Zellen) erkannt; diese werden aktiviert und zerstören durch Freisetzung zytotoxischer Substanzen die das Peptid präsentierende, virusinfizierte Zelle.
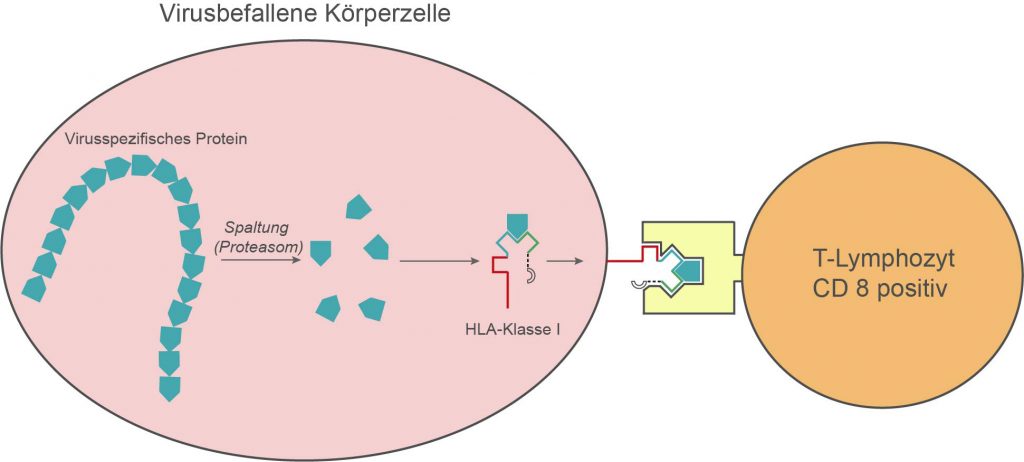
Antigenpräsentation durch HLA-Moleküle der Klasse I
Die Aktivierung der CD8-positiven T-Lymphozyten funktioniert nur, wenn die an die Viruspeptide gebundenen HLA-Moleküle der Klasse I mit den Klasse I-Molekülen der CD8-Zellen identisch sind. Mit anderen Worten: Killerzellen können infizierte Zellen nur dann zerstören, wenn diese die gleichen HLA-Antigene der Klasse I tragen wie sie selbst. Dieses Phänomen bezeichnet man als HLA-Restriktion der Zelllyse. Da nahezu alle Körperzellen Klasse I-Antigene synthetisieren können, ist dieses Phänomen für praktisch alle infizierten Körperzellen relevant.
Aktivierung von T-Helferzellen
Im Gegensatz zu Klasse I-Antigenen sind Klasse II-Antigene nur auf sogenannten Antigen-präsentierenden Zellen (APCs) vorhanden. Dies sind in der Regel phagozytierende Zellen wie Monozyten/Makrophagen, dendritische Zellen oder auch B-Lymphozyten. Exogene Fremdproteine (z.B. bakterieller Natur) werden von diesen Zellen phagozytiert, modifiziert, intrazellulär an HLA-Klasse II-Moleküle gebunden, an die Zelloberfläche transportiert und dort als Komplex den CD4-positiven T-Helferzellen des Immunsystems präsentiert. Auch hier gilt das Gruben- oder Taschenprinzip (s. oben). Allerdings sind HLA-Klasse II-Moleküle hinsichtlich der Peptidbindung weniger selektiv als HLA-Klasse I-Moleküle, da die sterische Form der DR-Moleküle eine höhere Variabilität der Bindung zulässt. Die Aktivierung der T-Helferzellen leitet durch Freisetzung von Zytokinen eine für das jeweilige Antigen spezifische Immunantwort ein (z.B. Aktivierung von Antigen-stimulierten B-Zellklonen zur Antikörperproduktion, Reifungsförderung von Antigen-stimulierten T-Killerzellen).
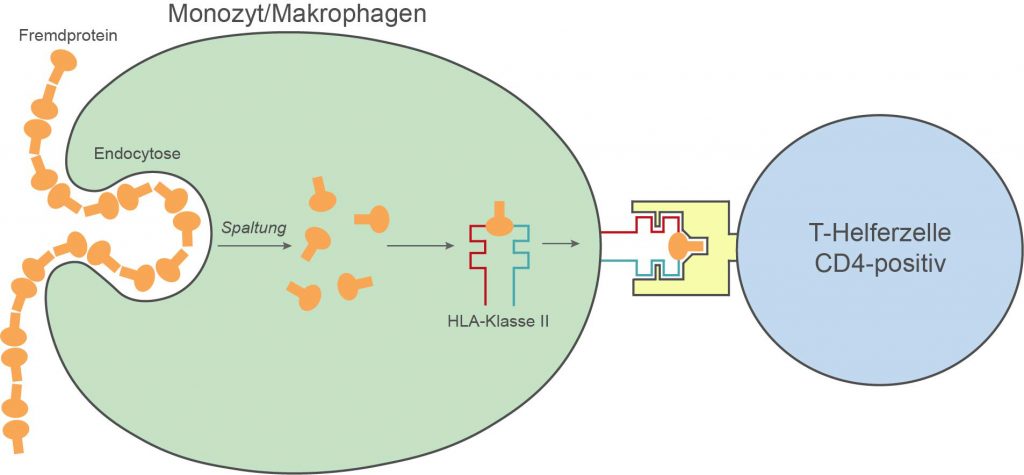
Antigenpräsentation durch HLA-Moleküle der Klasse II
Ähnlich wie bei der Aktivierung cytotoxischen Killerzellen ist also auch die Aktivierung der T-Helferzellen daran gebunden, dass von den phagozytierenden Zellen körpereigene HLA-Antigene zusammen mit dem Pathogen exprimiert werden (HLA-Restriktion der Immunantwort). Ohne Hilfe des „Präsentiertellers“ Klasse II-Antigen kann keine Immunantwort eingeleitet werden.
