Beim der Transfusionsassoziierten Lungeninsuffizienz (TRALI; engl. Transfusion-Related Acute Lung Injury) handelt sich um eine meist perakute Ateminsuffizienz, die in der Regel kurz nach Beginn einer Transfusion (spätestens bis zu 6 Stunden danach) von Gefrorenen Frischplasmen bzw. von Thrombozytenkonzentraten auftritt. Erythrozytenkonzentrate sind seltener betroffen.
Pathophysiologie
Pathophysiologisch geht man von einem sog. „two-hit“-Model aus, d.h. es bedarf zweier Schritte, um beim Patienten eine TRALI auszulösen:
- eine Sequestration von neutrophilen Granulozyten in den Lungenkapillaren
- eine Aktivierung der sequestrierten Granulozyten mit nachfolgender Schädigung der Lungenkapillaren durch die Transfusion.
Die Sequestration erfolgt vermutlich durch ein (aus welchen Gründen auch immer) bereits vorgeschädigtes Endothel der Lungenkapillaren. Durch die Vorschädigung kommt es zu einer Adhäsion zirkulierender neutrophiler Granulozyten in den Lungenkapillaren, getriggert beispielsweise durch Adhäsionsmoleküle oder durch die Freisetzung von Cytokinen. Die adhäsierenden Granulozyten sind dann besonders sensibel für jede weitere Aktivierung. Je nachdem, auf welchem Weg diese weitere Aktivierung erfolgt, spricht man von einem immunogenen oder nicht-immunogenen TRALI.
Immunogene TRALI
Auslöser der Aktivierung sind meist HNA– oder HLA-Antikörper im Plasma der Spenderinnen/Spender der transfundierten Blutkomponenten. Da derartige Antikörper häufig von multiparen Frauen gebildet werden, stellen GFP-Präparate von solchen Spenderinnen ein besonders hohes Risiko für die Entwicklung einer immunogenen TRALI dar. Erythrozytenkonzentrate hingegen lösen nur sehr selten eine immunogene TRALI aus, da sie nur sehr wenig Plasma enthalten. Die Antikörper gelangen durch die Transfusion in den Kreislauf der Patientinnen/Patienten, wo sie an die in der Lunge sequestrierten neutrophilen Granulozyten binden und diese aktivieren (Voraussetzung: die Granulozyten der Patientin/des Patienten tragen das korrespondierende Antigen). Die aktivierten Granulozyten sezernieren Sauerstoffradikale, Cytokine und proteolytische Enzyme. Die Folge ist eine Zunahme der Kapillarpermeabilität (bei bereits vorgeschädigtem Kapillarendothel) und die beobachtete pulmonale Insuffizienz. Insbesondere anti-HNA 3a-Antikörper können schwere immunogene TRALIs auslösen.
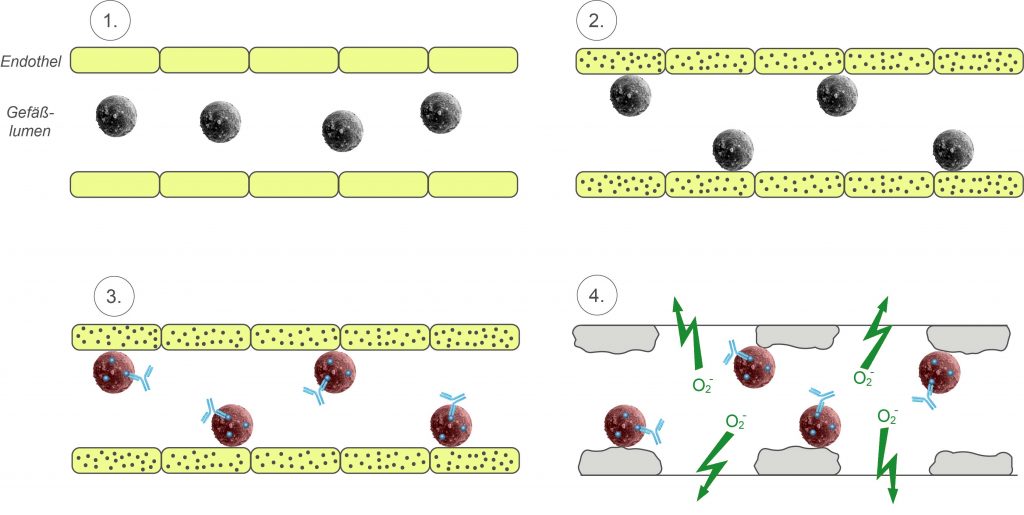
- Physologischer Zustand
- Vorschädigung Endothel + Bindung Granulozyten
- Bindung von Antikörpern aus transfundiertem GFP und Aktivierung der Granulozyten
- Freisetzung von O2–, Cytokinen und proteolytischen Enzymen; Zunahme der Kapillarpermeabilität
Nicht-immunogene TRALI
Auslöser sind meist sog. BRMs (biological response modifiers), welche in Erythrozytenkonzentraten oder Thrombozytenkonzentraten gebildet werden. Hierbei handelt es sich um Substanzen wie Lysophosphatidylcholine oder sekretorische Phospholipasen A2, welche – vergleichbar den HNA- oder HLA-Antikörpern bei der immunogenen TRALI – ebenfalls die in den Lungenkapillaren sequestrierten Granulozyten aktivieren können. Auch hier ist die Folge eine Freisetzung von Sauerstoffradikalen, Cytokinen und proteolytischen Enzymen mit einer Zunahme der Kapillarpermeabilität. Allerdings ist die Schädigung des pulmonalen Endothels durch nicht-immunogene TRALIs klinisch in der Regel wesentlich geringer ausgeprägt als durch immunogene TRALIs. Deshalb verlaufen nicht-immunogene TRALIs meist milder als immunogene TRALIs.
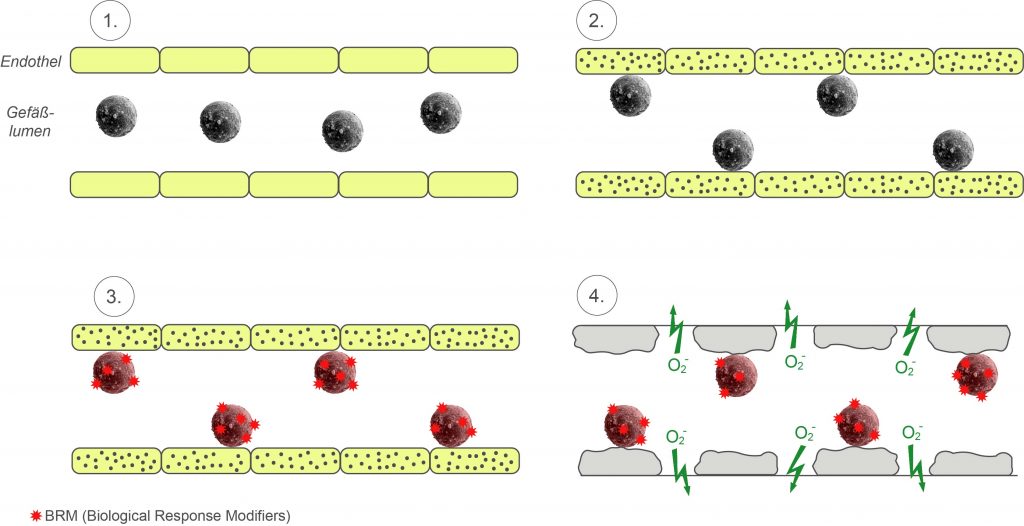
- Physologischer Zustand
- Vorschädigung Endothel + Bindung Granulozyten
- Bindung von BRMs aus transfundierten Erythrozyten- oder Thrombozytenkonzentraten und Aktivierung der Granulozyten
- Freisetzung von O2–, Cytokinen und proteolytischen Enzymen; Zunahme der Kapillarpermeabilität
Symptome/Diagnose
Meist kommt es innerhalb von Minuten nach Beginn einer Transfusion eines Gefrorenen Frischplasmas (GFP) oder eines Thrombozytenkonzentrates (gelegentlich auch bis zu ca. 6 Stunden danach) zu einer Hypoxie und Dyspnoe in unterschiedlich starkem Ausmaß. Im schlimmsten Fall kann dies bis hin zur akuten intubationspflichtigen Ateminsuffizienz reichen. Verbunden damit sind häufig ein Blutdruckabfall und ein Temperaturanstieg des Patienten. Radiologisch finden sich meist Verschattungen beider Lungenflügel, die einem ARDS (Acute Respiratory Distress Syndrom) sehr ähnlich sind. Bereits einige Milliliter des transfundierten GFPs oder Thrombozytenkonzentrates können ausreichen, um eine TRALI auszulösen.
Klinisch werden folgende Kriterien für die Diagnose eines TRALI gefordert:
- Akute, plötzliche Atemnot
- Hypoxämie (z.B. Sauerstoffsättigung kleiner 90% bei Raumluftatmung)
- Thorax- Röntgenaufnahme: Bilaterale Lungeninfiltrationen in unterschiedlichem Ausmaß (meist periphere Infiltrate in den unteren Lungenlappen, bis hin zur komplett „weißen Lunge“)
- Auftreten während oder innerhalb von 6 Stunden nach einer Transfusion
- Kein Anhalt für kardiogenes Lungenödem oder Volumenüberladung des Patienten
- Keine weiteren Risikofaktoren für eine pulmonale Insuffizienz (z.B. keine Aspiration, Pneumonie o.ä.)
Im Labor lassen sich häufig bei der Spenderin/dem Spender der auslösenden Blutkomponente HNA- oder HLA-Antikörper nachweisen. Allerdings gelingt dieser Nachweis nicht immer. Darüber hinaus dauern diese Analysen meist einige Zeit, so dass die Ergebnisse nur retrospektiv zur Diagnosesicherung herangezogen werden können. In einigen Fällen wurde ein akuter Abfall der neutrophilen Granulozyten im peripheren Blut des Patienten beschrieben (vermutlich ausgelöst durch eine zuzügliche Sequestration von Granulozyten in der Lunge).
Da es sich meist um kritisch kranke Patienten handelt, bei denen auch andere mögliche Gründe für eine akute Ateminsuffizienz vorliegen können und die Diagnose schnell und in erster Linie klinisch, d.h. ohne beweisende Laborparameter gestellt werden muss, ist die exakte Abgrenzung einer TRALI von einem ARDS anderer Ursache oft nicht einfach.
Therapie
Bei dem Verdacht auf TRALI ist immer der erste Schritt die sofortige Beendigung der Transfusion und das Anlegen eine Pulsoxymetrie (ggf. eine arterielle Blutgasanalyse). Eine Röntgenaufnahme des Thorax ist ebenfalls immer notwendig.
Im Vordergrund der gesamten Therapie steht die ausreichende Oxygenierung des Patienten, sei es – je nach Notwendigkeit – durch einfache Sauerstoffgabe, nicht-invasive Beatmung oder Intubation. In ca. 70% der Fälle ist eine invasive Beatmung erforderlich. Die Gabe von Steroiden ist allgemein üblich. Allerdings ist der Nutzen von Steroiden nicht in prospektiven klinischen Studien belegt, so dass manche Autoren Zurückhaltung bei der Gabe empfehlen. Bei der Applikation von Diuretika sollte man restriktiv sein, da diese in der Regel nicht zu einer Verbesserung der Symptomatik führt.
In jedem Fall ist bereits der TRALI-Verdacht der zuständigen Blutbank zu melden, da diese die involvierten Spenderinnen/Spender auf HLA- und HNA-Antikörper testen sollte. Einerseits, um die Diagnose zu verifizieren, andererseits aber auch, um weitere Spenden der betroffenen Spenderin/des betroffenen Spenders (wenn in dessen Serum HLA- oder HNA-Antikörper nachweisbar sein sollten) zu verhindern.
Prognose
Die Prognose ist sehr von der individuellen Situation abhängig. Hierzu gehören beispielsweise der „Grundzustand“ des Patienten, die Schwere der TRALI, die Aufrechterhaltung einer ausreichenden Oxygenierung und vieles mehr. In unkomplizierten Fällen bilden sich die Symptomatik sowie die röntgenologischen Lungeninfiltrate jedoch meist innerhalb von 3-4 Tagen zurück, nur selten dauert der Zustand über 7 Tage hinaus an.
Prophylaxe
Seit 1.9.2009 dürfen in Deutschland Frauen, die jemals schwanger waren, kein Plasma spenden, welches zur Herstellung von therapeutischen Einzelplasmen (GFP) verwendet wird. Eine Ausnahme ist nur dann möglich, wenn eine Testung auf HLA- und HNA- Antikörper negative Ergebnisse erbringt. Seit dieser Zeit sind die TRALI-Fälle in Deutschland deutlich rückläufig.
